Системное заражение бройлеров возбудителем MYCOPLASMA SYNOVIAE.
Калифорнийская Лаборатория системы здравоохранения животных и безопасности питания, Отделение Фресно, Университет Калифорнии, Дэвис, 2789 Саут Оранж Авеню, Фресно, CA, 93725, СШАБыл составлен отчет о системном заражении цыплят бройлеров в возрасте 47 дней возбудителем Mycoplasma synoviae c септицемическими повреждениями и увеличенным процентом отклонения тушек.
Клиническая история включала респираторные нарушения и увеличение синовиальной сумки киля. Отклонения на обрабатывающем заводе были связаны с аэросаккулитом и воспалением синовиальной сумки.
При полевых испытаниях редко наблюдаются случаи, когда задеты различные органы, включая синовиальную сумку киля, печень, селезенку, мозг, сосудистая оболочка глаза, нервы и скелетная мышца в связи с васкулитом и выделение M. synoviae из печени и синовиальной сумки киля. При расширенном произвольном полиморфном анализе ДНК M. synoviae, выделенного из цыплят бройлеров в настоящем исследовании, была получена картина, отличная от эталонных штаммов M. synoviae, WVU-1853, MS-H и F10-2AS, и другого изолята M. synoviae, полученного от производителей бройлеров из той же компании, но при этом сходная с картиной ДНК M.synoviae выделенного из цыплят бройлеров и индеек, принадлежащих той же компании. Это указывает на горизонтальное заражение, скорее, чем на вертикальную передачу инфекции.
Введение.
Инфекция Mycoplasma synoviae является заболеванием верхних дыхательных путей кур и индеек.
В большинстве случаев инфекция M.synoviae встречается бессимптомной; она может вызвать аэросаккулит при совмещении с вирусными инфекциями, такими как птичий парамиксовирус 1 (APMV-1) и инфекционный бронхит (Olson, 1984; Kleven, 2003). Реже заражение M. synoviae может становиться системным, вызывая экссудативный синовит в суставах и сухожильных влагалищах, и воспаление синовиальной сумки (King et al ., 1973). В таких случаях, M. synoviae может привести к значительным материальным потерям в результате снижения эффективности производства и выбраковки из-за аэросаккулита, синовита, воспаления синовиальной сумки и сепсиса (Kerr & Olson, 1967; Olson & Kerr,1967; King et al ., 1973; Timms, 1978; Kleven, 2003; Lockaby & Hoerr, 1999).
Настоящий отчет описывает заражение M. synoviae у цыплят бройлеров, страдающих системным повреждением, включающим различные органы, с высоким уровнем отбраковки при переработке.
Материалы и методы.
Анамнез. Пятьдесят девять живых птиц цыплят бройлеров, две мертвые и 16 частично переработанных тушки с нетронутыми внутренними органами в возрасте 47 дней были отобраны для лабораторного анализа и проведения тестов в Калифорнийской лаборатории системы охраны здоровья животных и безопасности питания, в отделение Фресно, между 20 и 27 декабря 2000г.
История болезни включает респираторные нарушения, воспаление синовиальной сумки киля, проблемы с лапками, повышенную смертность, и неравномерные размеры птиц. Процент отклонения тушек составлял 15% при обработке, в основном из-за аэросаккулита и воспаления синовиальной сумки (нормальный процент отбраковки при переработке составляет от 2% до 3%). Птицы были привиты от болезни Марека в возрасте одного дня, APMV-1 и инфекционного бронхита в возрасте 18 дней, и инфекционного заболевания синовиальной сумки в возрасте 12 дней. Общая смертность среди птиц за весь период роста до забоя варьировалась от 7.54% до 8.33% в зараженных стаях. Исходная стая цыплят бройлеров была также заражена M. synoviaе, о чем свидетельствует положительная серология и выделение M. synoviae.
Патология.
Живые птицы были обследованы на предмет клинических признаков и гуманно усыплены. Кровь из бедренной вены была собрана для проведения серологии.
Были произведены вскрытия всех предоставленных цыплят и тушек. Серьезные повреждения были обнаружены у 54 птиц, включая восемь частично переработанных тушек. За исключением отсутствия перьев и голов, которые были удалены при обработке, обработанные тушки были нетронутыми.
Срезы трахеи, легких, воздушного мешка, сердца, печени, почки, селезенки, фабрициевой сумки, зобной железы, зоба, железистого желудка, второго желудка, кишок, поджелудочной железы, скелетной мышцы, кости, периферического нерва, мозга, уха и глаза были зафиксированы в 10% нейтральном буферном формалине, обработаны и помещены в парафин.
Срезы были разрезаны от 4 до 7 мм, помещены на предметные стекла и окрашены гематоксилином и эозином. Микроскопические повреждения некоторых органов были оценены как легкие (_/) если наблюдалась инфильтрация нескольких клеток воспаления с небольшим количеством фибрина или без, средние (_/_/) если присутствовали от 10 до 20 клеток воспаления с фибрином или без, и серьезные (_/_/_/) если наблюдалось более 20 клеток воспаления с фибрином или без во всем образце в каждом поле зрения микроскопа под большим увеличением (40 x).
Бактериология. Двадцать одна синовиальная сумка киля, 14 трахей, 14 печенок, восемь воздушных мешков, четыре селезенки, три сустава и одна околосердечная сумка были культивированы в 3% овечьем кровяном агаре и чашках с агаровой средой MacConkey (Remel, Lenexa, Канзас, США), и инкубированы при 37ºC с 8% CO2 в течение от 24 до 48 часов. Для выделения микоплазмы, 21 синовиальная сумка киля, 11 воздушных мешков, 10 трахей, шесть мозгов, четыре печени и три сустава были культивированы с использованием питательной среды Фрея и агаровой среды дополненной 12% такого же объема лошадиной и свиной сыворотки. Ацетат таллия (1:4000) и пенициллин (1000 IU/мл) были добавлены как бактериальные ингибиторы. Чашки были размещены при температуре 37ºC с 8% CO2, 98% относительной влажности и проверялись в течение двух недель на типичные колонии микоплазмы.
Расширенный произвольный полиморфный анализ ДНК для определения M. synoviae.
Шесть полевых образцов M. synoviae были сравнены при помощи расширенного произвольного полиморфного анализа ДНК (RAPD) с последующим проведением процедуры описанной Fan и другими (1995). Два образца были взяты из синовиальной сумки киля бройлеров в этом исследовании с воспалением синовиальной сумки киля. Два образца из трахеи цыплят бройлеров в возрасте 33 и 39 дней, у которых была диагностирована тяжелая форма трахеита и аэросаккулита. Один образец был взят из трахеи бройлера производителя в возрасте 51 недели без клинических симптомов, той же компании что и бройлеры, использованные в настоящем исследовании без клинических признаков. Еще один образец был взят из трахеи индейки мясной породы выращиваемой для продажи в возрасте 15 дней из стаи индеек, у которых был диагностирован синовит и трахеит. Индейка была из той же компании, что и бройлеры и бройлер производитель, и стая индеек была выращена на той же общей площади, вместе с цыплятами.
В дополнение, три эталонных образца MS-H, WVU-1853 и F10-2AS, были проанализированы при помощи RAPD (Yogev и другие ., 1988).
Серология. Сыворотка от 45 птиц была проверена на антитела Mycoplasma gallisepticum и M. synoviae при помощи теста реакции агглютинации на пластинке в соответствии с инструкциями производителя (Intervet Inc., Миллсборо, Дэлавэр, США); образцы сыворотки показывающие агглютинацию при разведении 1:10 или выше считались положительными; образцы сыворотки показавшие агглютинацию при разведении 1:5 считались подозрительными. Сыворотки были проверены на антитела к инфекционному бронхиту (серотипы Арканзас 99, Коннектикут, и Массачусетс 41), M. gallisepticum и M. synoviae используя стандартные процедуры теста реакции гемагглютинации (HI) (Thayer & Beard, 1998). На M. synoviae, образцы сыворотки с титром HI ≥1:80 читались положительными, образцы сыворотки с титром HI 1:20 или 1:40 подозрительными. Серология M. synoviae, APMV-1, вируса инфекционного бронхита, вируса воспаления синовиальной сумки и реовируса была проведена с помощью твердофазного иммуноферментного анализа (ЭЛАЙЗА) (IDEXX Laboratories, Inc., Вестбрук, Майне, США); M. synoviae, сыворотка с титрами группы 1 и выше считались положительными согласно инструкциям производителя.
Вирусология. Образцы трахеи и легких были смешаны, и были взяты отдельные образцы миндалины слепой кишки, мозга и тканей железистого желудка были собраны по отдельности в медиум переносящий вирусы. Каждый орган был превращен в тканевый пул и ткани были протерты и суспензии были очищены центрифугированием при 1780 об. в течение 10 минут при 48ºC, и затем отфильтрованы через мембранный фильтр 0.2 мм. Надосадочная жидкость была инокулирована в аллантоис и на хорионаллантоисную мембрану специальных безпатогенных 10 дневных куриных яиц (SPAFAS; Сторрс, Коннектикут, США). Яйца были инкубированы при температуре 37ºC и просвечивались ежедневно до 7 дней. Два серийных прохода хорионаллантоисной жидкости в яйцах с развивающимся эмбрионом были выполнены с использованием стандартного метода (Senne, 1998).
Результаты:
Общая патология. Частота и серьезность макроскопических повреждений отобранных органов представлены в Таблице 1. Повреждения, обнаруженные при вскрытии, включали увеличение синовиальной сумки киля от среднего до сильного сопровождающегося скоплением фибринозных и/или казеозных выделений и редко петехией (Рисунок 1a,1b). Печенки были немного или сильно увеличены с явной сетчатой структурой, и иногда имели зеленый оттенок (Рисунок 2).
Селезенки были средне или сильно увеличены с белыми вкраплениями (Рисунок 3). Скакательные суставы были немного увеличены, что сопровождалось скоплением фибринозных и/или казеозных выделений у пяти птиц. Другие повреждения. Включали от среднего до сильного скопления фибринозных и/или казеозных выделений в воздушных мешках, перикарде и оболочке печени; перегрузку легких; от среднего до сильного ослабления фабрициевой сумки и тимуса; небольшое увеличение и бледность почек; небольшое утолщение стенки железистого желудка и небольшое увеличение слизи в трахее.
Гистопатология. Относительная частота и серьезность микроскопических повреждений в отобранных органах представлены в Таблице 2.
Синовиальная сумка киля. Синовит от среднего до сильного характеризующийся инфильтрацией клеток лимфоцитов и плазмы от среднего до сильного, особенно возле кровеносных сосудов (Рисунок 4a). Эндотелиевое покрытие сосудов были гипертрофированны и некоторые содержали вакуолизированную цитоплазму. Наблюдалась инфильтрация лимфоцитов и нескольких клеток плазмы в стенках сосудов (Рисунок 4b). Дополнительно, наблюдалось умеренное до сильного скопление фибрина смешанного с большим количеством гетерофилов и несколькими лимфоцитами и макрофагами. Также наблюдалось образование лимфотических узлов и фиброз на поверхности синовиальной оболочки.
Суставы. Синовиальный слой скакательного сустава и несколько межпозвоночных суставов были утолщены в связи с умеренной до сильной инфильтрацией клеток лимфоцитов и плазмы. Было несколько птиц со схожими повреждениями, но с небольшим фибринозно-гетерофильным воспалением.
Печень. Наблюдалась инфильтрация клеток лимфоцитов и плазмы от средней до сильной в кровеносных сосудах и вокруг воротных триад и нескольких центральных вен (Рисунок 5). Сходно с сосудами в синовиальной сумке киля, эндотелиальные клетки выстилающие печёночные сосуды, также были гипертрофированны с вакуолизированной цитоплазмой.
Другие изменения состояли в увеличенной насыщенности клетками синусоидных капилляр, образовании лимфатических узлов и многоочаговом одноклеточном некрозе гепатоцитов.
Фиброзная капсула печени была умеренно или значительно пропитана фибрином смешанным с гетерофилами и несколькими лейкоцитами.
Таблица 1.
Частота и серьезность макроскопических повреждений связанных с M. synoviae в отобранных органах цыплят бройлеров.| Повреждение | Серьезность повреждений | + | +/% | ++ | ++/% | +++ | +++/% |
|---|---|---|---|---|---|---|
| Воспаление синовиальной сумки киля | 8 | 15 | 21 | 39 | 20 | 37 |
| Синовит | _/ | _/ | 5 | 9 | _/ | _/ |
| Трахеит | 11 | 20 | _/ | _/ | _/ | _/ |
| Аэросакулит | _/ | _/ | 5 | 9 | 5 | 9 |
| Перикардит | 1 | 2 | 1 | 2 | 3 | 6 |
| Гепатит | _/ | _/ | 14 | 26 | 6 | 11 |
| Спленит | _/ | _/ | 6 | 11 | 9 | 17 |
| Нефрит | 3 | 6 | 3 | 6 | 5 | 9 |
Таблица 2.
| Повреждение | Число исследованных птиц | Серьезность повреждения | + | + % | + + | + + % | + + + | +++ % |
|---|---|---|---|---|---|---|---|
| Воспаление синовиальной сумки | 57 | 1 | 2 | 10 | 18 | 31 | 57 |
| Синовит | 17 | - | - | 2 | 12 | 5 | 29 |
| Гепатит | 47 | 13 | 28 | 10 | 21 | 19 | 40 |
| Спленит | 22 | - | - | 10 | 45 | 12 | 55 |
| Трахеит | 26 | 5 | 19 | 10 | 38 | 2 | 7 |
| Аэросаккулит | 9 | - | - | - | - | 9 | 100 |
| Пневмония | 15 | 4 | 27 | 3 | 20 | 1 | 20 |
| Нефрит | 21 | 8 | 38 | 5 | 24 | 1 | 5 |
| Энцефалит | 8 | - | - | 2 | 25 | 2 | 25 |
| Конъюнктивит/ хориоидит | 6 | - | - | 3 | 50 | 3 | 50 |
Мозг. Наблюдалась многоочаговая инфильтрация лимфоцитов и нескольких клеток плазмы в и вокруг сосудов нейропиля от легкой до умеренной (Рисунок 6). Изменения в эндотелиальных клетках были схожи с изменениями в сосудах синовиальной сумки киля и печени.
Другие изменения состояли в легком или среднем васкулите и периваскулярном образовании скоплений вокруг кровеносного сосуда в основном лимфоцитов внутри мягких мозговых оболочек.
Глаза. Наблюдалось от легкой до средней инфильтрации лимфоцитов смешанных с несколькими клетками плазмы и отдельные случаи присутствия гетерофилов в собственно сосудистой оболочке глаза (Рисунок 7). Другие изменения состояли в похожих инфильтрациях в слизистой оболочке глаза, радужке, ресничном теле и придатке, эписклере и оптических нервах. Некоторые мышцы вокруг белочной оболочки глаза имели несколько лимфатических очагов.
Скелетная мышца. У некоторых сосудов наблюдалось легкий или умеренный фибриноидный некроз средней оболочки и легкие лимфатические инфильтрации. В остальном, мышцы выглядели нормально за исключением нескольких очагов лимфоцитов.
Другие органы. Наблюдалась легкая или умеренная инфильтрация лимфоцитов смешанных с несколькими клетками плазмы и макрофагами с образованием лимфоидных узлов в слизистых оболочках, подглазничных синусов, трахеи, фистул, бронхиальной слизистой, миокарда, воздушного мешка и перикардия, и в интерстициальной ткани почек и железистой части железистого желудка. Дополнительно, воздушный мешок, перикардий и кожа нескольких птиц имели сильное фибринозно-гнойное воспаление. В селезенке наблюдалось умеренное или сильное многоочаговое увеличение одноядерных клеток фагоцитарной системы, и васкулит, характеризованный инфильтрацией лимфоцитов в, и вокруг кровеносных сосудов. Наблюдалось умеренное до сильного лимфатическое снижение в фабрициевой сумке и зобной железе.
Бактериология. M. synoviae был выделен из воздушного мешка (3/11), синовиальной сумки киля (5/21), трахеи (3/14), суставов (3/3), и печени (1/4). Escherichia coli был выделен из воздушного мешка (5/12), околосердечной сумки (1/2), печени (3/4), синовиальной сумки киля (9/21), и трахеи (11/14). Другие полученные бактерии включают Staphylococcus spp. из синовиальной сумки киля (1/4) и печени (7/21); Ornithobacterium rhinotracheale из трахеи (3/14); b-haemolytic Streptococcus из трахеи (3/14); Bordetella avium из трахеи (2/14); и Gallibacterium anatis var. haemolyticum был получен из трахеи (4/14).
Анализ RAPD на M. synoviae.
Модель перемещения ДНК шести полевых изолятов и трех эталонных штаммов M. synoviae представлены на Рисунке 8. Один изолят от каждого исследуемого бройлера, в возрасте от 33 до 39 дней и индеек мясной породы, имели сходную модель перемещения (Рисунок 8, линии 1, 4 и 6, соответственно). Два изолята, один полученный из цыпленка бройлера с воспалением синовиальной сумки и один от бройлеров в возрасте от 33 до 39 дней (Рисунок 8, линии 2 и 3), выглядели похожими на предыдущие три изолята, но были неопределенными. Изолят M. synoviae от бройлера –производителя отличался от других штаммов (Рисунок 8, линия 5). Все шесть полевых штаммов M. synoviae имели различные модели перемещения по сравнению с тремя эталонными штаммами M. synoviae (Рисунок 8, линии 7, 8 и 9).
Серология При реакция агглютинации на пластинке, 28/33 сывороток были положительными и 3/33 с подозрением на M. synoviae. В HI тестах, 5/33 сывороток были положительными и 18/33 с подозрением на M. synoviae. При проведении теста ELISA, 13/33 сывороток были положительными на M. synoviae. Все сыворотки были отрицательными на M. gallisepticum.
Титры для APMV-1, вируса инфекционного бронхита, и инфекционного заболевания синовиальной сумки были совместимы с вакцинными титрами.
Вирусология. Аденовирус был выделен из смешанного образца трахеи/легкого и железистого желудка. Никаких других вирусов, включая APMV-1 и инфекционный бронхит не были выделены из мозга, железистого желудка, трахеи/легкого и миндалевидных желёз слепой кишки.
Выводы:
Макроскопические и микроскопические повреждения наблюдавшиеся у бройлеров в этом исследовании могут считаться клиническими признаками увеличенной смертности и отклонений на фабрике по переработке. Воспаление синовиальной сумки киля и аэросаккулит являлись основными причинами повышенного процента брака. Процент брака был намного выше (до 15%) у этих цыплят бройлеров по сравнению с 1.88% брака, о которых сообщалось ранее у потомства производителей зараженных M. synoviae (King и другие., 1973). Инфекция M. synoviae, возможно, являлась основной причиной появления клинических признаков и повреждений.
Инфекция M. synoviae подтвердилась выделением ее из синовиальной сумки киля, воздушных мешков, трахей, скакательных суставов и одной печени. Многие образцы сыворотки были положительными на M. synoviae согласно различных серологических тестов, что говорит о недавнем заражении M. synoviae. Другие бактерии, такие как E. coli и O. rhinotracheale, могут быть отнесены на счет серьезности клинических признаков, повреждений и смертности цыплят.
Аденовирус был выделен из общего образца трахеи/легкого и железистого желудка. Значение аденовируса у этих цыплят бройлеров не может быть определено; аденовирусы у кур являются повсеместными (McFerran & Adair, 2003) и включения аденовируса не было обнаружено ни в одном органе.
Соматическое представление M. synoviae у цыплят бройлеров с сильным воспалением синовиальной сумки, гепатитом, спленитом, энцефалитом, миокардитом, хориоидитом и иридоциклитом, в дополнение к синовиту, синуситу, трахеиту, бронхиту и аэросаккулиту не обычно для полевых случаев заболевания. Васкулит, особенно синовиальной сумки, печени, селезенки, мозга, скелетной мышцы, и собственной сосудистой оболочки глаза также присутствовали. Такие систематические повреждения иногда с васкулитом были вызваны экспериментальным заражением M. synoviae (Kerr & Olson, 1970; Kawakubo и другие, 1980). Как правило, заражение M. synoviae у молодых цыплят, разводимых в полевых условиях, являются субклиническими, но иногда наблюдается клиническая стадия заболевания верхних дыхательных путей, особенно в присутствии APMV-1 и/или вируса инфекционного бронхита (Kleven, 2003). В таких случаях, макроскопические повреждения, если есть, как правило, находятся в дыхательных путях, в основном состоят из аэросаккулитов (Ghazikhanian и другие, 1973; Olson, 1984; Kleven, 2003). Лимфоплазмоцитарная инфильтрация с образование лимфатических узлов и гетерофильная инфильтрация обнаруженные в некоторых органах являются распространенными повреждениями связанными с систематическим заражением M. synoviae. Смешанные воспалительные инфильтраты, обнаруженные у этих птиц, были сходны с заявленными прежде (Sevoian и другие, 1958; Kerr & Olson, 1970; Kleven и другие, 1975; Fletcher и другие, 1976; Kawakubo и другие, 1980; Olson, 1984; Lockaby и другие, 1998; Lockaby & Hoerr, 1999).
Васкулит вызванный штаммом Mycoplasma не типичен для цыплят и индеек, но был обнаружен у индеек зараженных M. synoviae и также M. gallisepticum (Cordy & Adler, 1957, 1965; Chin и другие ., 1991 a,b). Повреждения от васкулита, вызванного изолятом M. synoviae WVU-1853 у кур породы несушек в возрасте от 4 до 8 недель, включали от легкого до умеренного фибриноидного некроза средней оболочки и инфильтрацию лимфоцитов и нескольких клеток плазмы в сосудах сердца, селезенки и клубочков почек среднего размера и периваскулярное образование скоплений лейкоцитов вокруг кровеносных сосудов мозга (Kawakubo и другие .,1980). В противоположность, васкулит не был обнаружен у цыплят бройлеров после экспериментальной инокуляции шестью изолятами M. synoviae включая изолят WVU-1853, у цыплят-бройлеров в возрасте одного дня, которые были обследованы через 7 и 42 дня после инокуляции (Lockaby и другие,1998). Это отличие может быть связано с типом использованных цыплят, разницы в возрасте птиц во время инокуляции и путей инокуляции.
Патогенез васкулита или систематического заражения некоторыми изолятами M. synoviae не известны. Предполагались такие факторы как изменение патогенности и тропизма тканей различных штаммов M. synoviae (Kleven и другие, 1975; Olson, 1984; Lockaby и другие ., 1998; Kang и другие, 2002). Другие факторы, такие как цитоадгезия, мембранный белок, способствующие тесному присоединению организмов к клетке-хозяину, воздействие на иммунную систему организма носителя, токсины, т-стимуляция клеточного деления тканей, наносящих вред, предполагались, но не были подтверждены (Lockaby и другие., 1999; Kleven, 2003).
Самыми серьезными повреждениями, обнаруженными у птиц в этом исследовании были воспаление синовиальной сумки и гепатит на втором месте. Скакательные суставы были поражены только у нескольких птиц.
Это первый отчет о связи M. synoviae с повреждениями глаз и частями глаза.
RAPD анализ показал, что полевые изоляты от этих бройлеров отличались от эталонных штаммов WVU-1853, MS-H и F10-2AS. В предыдущих исследованиях, эталонный изолят, WVU-1853, вызывал системные повреждения (Kawakubo и другие, 1980; Kerr & Olson, 1970; Lockaby и другие, 1998) сходно с бройлерами в настоящем исследовании, включая васкулит в одном исследовании (Kawakubo и другие,1980). Интересно то, что изоляты из бройлеров не были похожи на полученные от стаи производителей, но были похожи на изоляты от стаи других бройлеров и стаи индеек, выращиваемых в торговых целях, принадлежащих одной компании. Можно сделать заключение, что изоляты в компании распространялись горизонтально, а не вертикально от производителей. В дополнение, это указывает на то, что различные изоляты M. synoviae, с различной патогенностью, могут присутствовать на одной птицеферме.
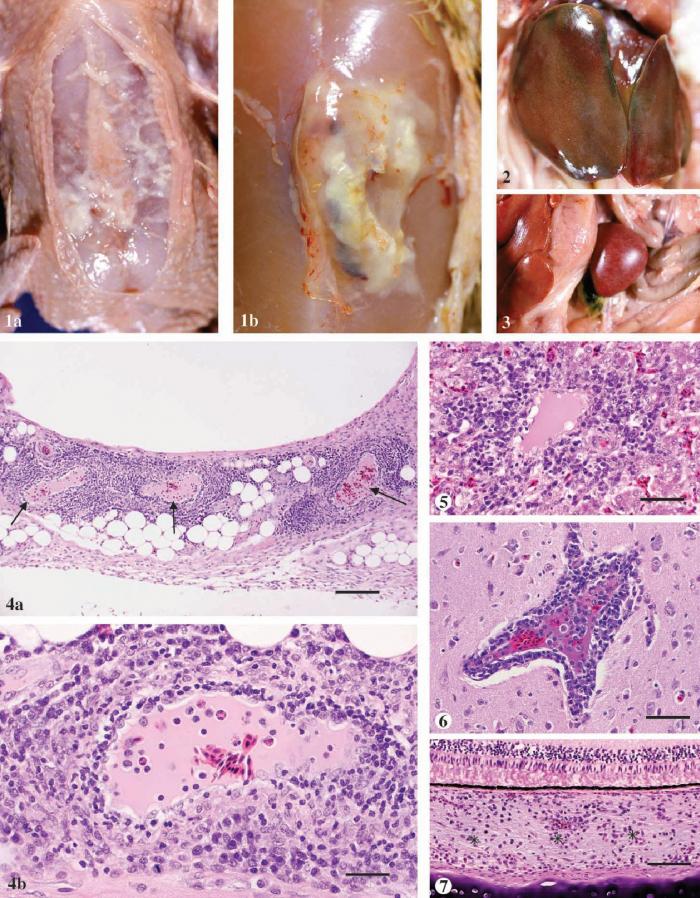
Рисунок 1.
1a: Подкожное, диффузное накопление фибринозного экссудата в и вокруг синовиальной сумки киля у тушки цыпленка бройлера зараженного M. synoviae.
1b: Распространенное локализованное накопление казеозного экссудата в синовиальной сумке киля цыпленка бройлера в возрасте 47 дней зараженного M. synoviae.
Рисунок 2. Увеличенная печень с зеленоватым оттенком и рассеянным бледным сетчатым узором цыпленка бройлера в возрасте 47 дней зараженного M. synoviae.
Рисунок 3. Увеличенная крапчатая селезенка цыпленка бройлера в возрасте 47 дней зараженного M. synoviae.
Рисунок 4.
4a: Синовиальная сумка киля цыпленка бройлера в возрасте 47 дней зараженного M. synoviae показывающая сильное периваскулярное образование скоплений лейкоцитов вокруг кровеносного сосуда (стрелочки) одноядерными клетками воспаления. Гематоксилин и эозин, bar =200 µm.
4b: Большее увеличение одного участка рисунка 4a, более подробно показывающее выступающие эндотелиальные клетки и инфильтрацию лимфоцитов, несколько клеток плазмы и макрофагов вокруг кровеносного сосуда. Гематоксилин и эозин, bar = 50 µm.
Рисунок 5. Печень цыпленка бройлера в возрасте 47 дней зараженного M. synoviae, показывает выделяющиеся и вакуолизированные эндотелиальные клетки и инфильтрацию лимфоцитов, несколько клеток плазмы и макрофагов в и вокруг кровеносного сосуда. Гематоксилин и эозин, bar =75µm.
Рисунок 6. Мозг цыпленка бройлера в возрасте 47 дней зараженного M. synoviae, в котором наблюдается инфильтрация главным образом лимфоцитов в и вокруг кровеносного сосуда. Гематоксилин и эозин, bar =85µm.
Рисунок 7. Сосудистая оболочка глаза (*)цыпленка бройлера в возрасте 47 дней зараженного M. synoviae, с инфильтрацией лимфоцитов в смеси с несколькими клетками плазмы. Гематоксилин и эозин, bar =100µm.

Рисунок 8. RAPD анализ изолятов M. synoviae. Линии 1 и 2, изолятов от цыпленка бройлера в возрасте 7 дней; линии 3 и 4, изолятов от цыплят бройлеров в возрасте от 33 до 39 дней; линия 5, изоляты от индейки; линия 6, изолят от бройлера производителя; линия 7, MS-H эталонный штамм; линия 8, WVU 1853 эталонный штамм; линия 9, F10-2AS эталонный штамм; линия 10, отрицательный контроль; линия 11, 100 логическая схема пары оснований.

 ВЕТЕРИНАРНЫЕ ПРЕПАРАТЫ
ВЕТЕРИНАРНЫЕ ПРЕПАРАТЫ